Aqui você encontra a transcrição do Trabalho de Conclusão de Curso apresentado ao Instituto Velasco, como requisito para obtenção do título de Especialista em Harmonização Orofacial da Dra. Gisele Cristina Bortolini. Orientador: Professor Rogério Gonçalves Velasco.
Veja no final deste artigo como assistir à apresentação do trabalho e baixar o arquivo em PDF.
1. INTRODUÇÃO
A história relata e descreve como se deu a busca pela beleza ao longo das eras. Cada período histórico tem, ou teve, seu próprio padrão de beleza. O que era considerado bonito e atraente ontem, hoje parece estranho e louco. Para cada povo, para cada região e em cada época da humanidade o padrão de beleza se apresenta de acordo com o que é considerado aceitável e bom às aspirações políticas ou às religiosas. Eram buscadas formas, cores e medidas para o corpo, cabelos, maquiagem e roupas; tudo o que pudesse aparentar uma autoaceitação à sociedade.
Com a chegada da contemporaneidade, o processo de globalização de informações fez com que os países estabelecessem conexões e realizassem trocas. Com isso, a concepção do que é ou não bonito se alterou, fazendo com que o padrão estético se tornasse cada vez mais parecido, independentemente da etnia ou região a qual pertencia.
A corrida pela beleza atingiu todas as áreas da saúde e do comércio. Nas academias de ginástica, nutricionistas e clínicas médicas, a estética se tornou o carro chefe, com o apelo à harmonização e à perfeição dos traços. Porém, alcançar só a beleza não é a única busca das pessoas: elas buscam por saúde, função, beleza, rejuvenescimento, harmonia e bem-estar, além da necessidade de autoaceitação e autoafirmação perante os outros.
Por consequência, a área odontológica precisou se modificar e evoluir para atender às reivindicações dos pacientes que buscavam não só por melhorias em sua mastigação, mas também por um sorriso bonito e uma aparência harmônica em seu rosto, o que fosse capaz de transmitir equilíbrio e jovialidade. A Harmonização Orofacial tornou-se realidade nos consultórios odontológicos, dando ao cirurgião- dentista a capacidade de tornar os traços da face mais equilibrados, sem interferir nas funções básicas do sistema estomatognático. Além disso, as técnicas de Harmonização Orofacial propiciaram o tratamento de vários outros distúrbios, dentre eles o melasma.
A harmonização orofacial, também conhecida pela sigla HOF, é uma especialidade da odontologia composta por um conjunto de procedimentos estéticos combinados para melhorar a harmonia do rosto, realçando a beleza e corrigindo pequenos detalhes. Para tal, usa-se, em geral a toxina botulínica, preenchimento com ácido hialurônico, fios de sustentação, fios lisos para estímulo de colágeno, bioestimuladores, plasma rico em plaquetas (PRP), peelings, microagulhamento, entre outros procedimentos e elementos.
Uma queixa comum e que também abrange a área de atuação da HOF é a presença dos melasmas na pele. O melasma, por sua vez, é um distúrbio hiperpigmentar da pele que incomoda e afeta a autoestima do paciente, causando desde estresse emocional, ansiedade e doenças sistêmicas até patologias mais graves, como depressão.
Dos pacientes que desenvolvem distúrbios na pele estima-se que cerca de um terço sofrem de problemas emocionais e psicológicos, na maioria das vezes devido ao aspecto das lesões, que permanecerem visíveis, problema esse que afeta o relacionamento pessoal, social e profissional do paciente, sendo necessária uma preocupação maior na avaliação dos fatores que influenciam estas alterações, que afetam a qualidade de vida desses pacientes.
Nesse ínterim, abrangendo o que foi brevemente exposto até então, este é um trabalho de revisão de literatura que tem por objetivo discutir, a partir de fontes científicas, os resultados alcançados para o tratamento do melasma com uso de plasma rico em plaquetas (PRP).
2. ANATOMIA E FISIOLOGIA DA PELE
A pele é o mais visível aspecto do fenótipo humano e sua cor é um de seus fatores mais variáveis. Pouco se conhece sobre as bases genéticas, evolutivas e os aspectos culturais relacionados ao estabelecimento dos padrões de cor da pele humana (COSTIN; HEARING, 2007; MIOT et al., 2007). Acredita-se que as variações, na cor da pele, sejam ganhos evolutivos e estejam relacionadas com a regulação da penetração da radiação ultravioleta (RUV) (SULEM, 2007; ORTONNE, 2005).
A síntese de vitamina D na pele, degradação de ácido fólico pela RUV, resistência à exposição solar direta e elementos culturais são argumentos sobre os quais tentam explicar a distribuição fenotípica da cor da pele em diferentes latitudes do planeta (JABLONSKI; CHAPLIN, 2000; RELETHFORD; HEMISPHERIC, 1997). A cor da pele humana normal é principalmente influenciada pela produção de melanina, um pigmento castanho denso, de alto peso molecular, o qual assume o aspecto enegrecido, quanto mais concentrado (MOSHER et al., 1999; LIN; FISHER, 2007).
No entanto, pigmentos exógenos amarelos, os carotenoides, também contribuem para a coloração da pele, assim como o vermelho endógeno, da hemoglobina oxigenada nos capilares da derme e azul endógeno, da hemoglobina reduzida nas vênulas (MOSHER et al., 1999; LIN; FISHER, 2007).
Em humanos, a pigmentação da pele e dos cabelos é dependente da atividade melanogênica, dentro dos melanócitos, e da taxa de síntese de melanina, bem como do tamanho, número, composição e distribuição de partículas do citoplasma dos melanócitos, denominadas melanossomas, além da natureza química da melanina que elas contêm (SULAIMON; KITCHELL, 2013; JIMBOW et al., 1999). Os melanócitos e os melanossomas têm seu número relativamente constante, em diferentes etnias, como discutido adiante (LIN; FISHER, 2007).
A pele humana é um órgão sofisticado, morfofuncional e o mais perfeito do corpo humano, e consiste em três componentes: Epiderme; Derme; e Tecido adiposo subcutâneo ou hipoderme.
Cada elemento é orientado no espaço sob a forma de um complexo funcional estrutural e consiste em estruturas celulares, fibrosas e amorfas.
2.1 EPIDERME
Figura 1 – Componentes da pele. Lopandina (2018).
A epiderme é a camada superior da pele que consiste predominantemente em estruturas celulares, com grande capacidade de multiplicar e substituir várias lesões. Ela realiza funções de barreira, protetora, imunológica, secretora, sinalizadora e endócrina (LOPANDINA, 2018). As principais células dessa camada são os queratinócitos, melanócitos, células de Langerhans e células de Merkel (LOPANDINA, 2018).
2.1.1 Melanócitos
Na pele, os melanócitos estão presentes na camada basocelular da epiderme, ocasionalmente na derme, e são responsáveis pela pigmentação da pele e dos pelos, contribuindo para a tonalidade cutânea e conferindo proteção direta aos danos causados pela radiação ultravioleta (MIOT et al., 2009), sendo também responsáveis pela produção de um pigmento conhecido como melanina. A proporção existente é de cerca de um melanócito para cada cinco células basais. Cada melanócito fornece pigmento para muitos queratinócitos, e essa associação é denominada unidade epidérmico-melânica. Os queratinócitos fagocitam as porções dendríticas dos melanócitos preenchidas com melanina e, portanto, a pigmentação da pele de um indivíduo depende basicamente da quantidade de melanina transferida para o queratinócito (DU VIVIER, 2004).
Figura 2 – Disposição dos melanócitos na epiderme e sua relação com os queratinócitos. Fonte: Storm et al. (2006).
Figura 3 – Disposição dos melanócitos na epiderme e sua relação com os queratinócitos [2].Fonte: mol.icb.usp.br.
Figura 4 – Disposição dos melanócitos na epiderme e sua relação com os queratinócitos [3]. Fonte: coladaweb.com.br.
O número de melanócitos diminui com a idade, em áreas não fotoexpostas, na proporção de 6 a 8% por década, sendo que as diferenças raciais na pigmentação não são devidas a uma marcante variação no número de melanócitos, mas sim ao seu grau de atividade (síntese de melanina e melanossomas), a uma proporção dos subtipos de melanina (feomelanina e eumelanina), a suas distribuições e envolvimento de fatores ambientais, como a exposição solar, já que estimulam diretamente a síntese de melanina (JIMBOW et al., 1999; JONES, 2002).
Os melanócitos derivam dos melanoblastos que migram da crista neural (uma estrutura ectodérmica) durante o desenvolvimento fetal. São os melanócitos que protegem principalmente contra a luz ultravioleta (DU VIVIER, 2004).
2.1.1.1 Melanossomas
No citoplasma dos melanócitos existem múltiplos melanossomas, estruturas que realizam a biossíntese da melanina, que é formada a partir do aminoácido tirosina sob influência de enzimas catalíticas – tirosinase e DOPA (LOPANDINA, 2018). Melanossomas são organelas elípticas, altamente especializadas, nas quais ocorre síntese e deposição de melanina (Figura 5), armazenamento de tirosinase sintetizada pelos ribossomos e representam a sede dos fenômenos bioquímicos em que originam a melanina (MOSHER et al., 1999).
Figura 5 – Esquema de produção e distribuição de melanina na epiderme através dos melanossomas. Fonte: Storm et al. (2006).
A síntese de melanina ocorre, exclusivamente, nos melanossomas, sendo dependente de vários genes.
Figura 6 – Esquema de produção e distribuição de melanina na epiderme através dos melanossomas [2]. Fonte: Lopandina (2018).
Os melanossomos apresentam quatro estágios evolutivos (maturação da melanina), estágio de I a IV, à medida que passam da área perinuclear do melanócito para os dendritos (DU VIVIER, 2004). Desenvolvem-se em uma série de estágios morfologicamente definidos (Figura 7), desde estruturas despigmentadas (estágio I) até organelas listradas repletas de melanina (estágio IV) (JIMBOW et al., 1999; BOLOGNIA; ORLOW, 2003).
Figura 7 – Características morfológicas dos melanossomas em seus diversos estágios. Fonte: Bolognia; Orlow (2003).
A diferença fenotípica fundamental entre as raças mais e menos pigmentadas não reside na produção de melanina ou no número de melanócitos, mas principalmente, na qualidade de seus melanossomas (BOLOGNIA; ORLOW, 2003). Os melanossomas nos indivíduos negros são maiores e mais maduros do que nos brancos, sendo armazenados mais como unidades do que como grupamentos. Nos ceratinócitos, a degradação dos melanossomas maiores é retardada, o que também contribui para os níveis mais altos de pigmentação cutânea nesses casos (SULAIMON; KITCHELL, 2003). Os processos que levam a essa diferença de comportamento precisam ser mais bem elucidados.
Nos melanossomas da pele normal, a melanina é extremamente densa, sendo um polímero nitrogenado, insolúvel e de alto peso molecular, formando um pigmento que, além de dar cor à pele, desempenha função protetora, filtrando e absorvendo as RUV. Desempenha, portanto, um importante papel fotoprotetor contra danos da RUV, como evidenciado por uma inversa correlação entre o conteúdo de melanina da pele humana e a incidência de carcinomas de pele e melanomas (JIMBOW et al., 1999; ROUZAUD et al., 2005).
2.1.1.2 Melanina
A melanina é o principal pigmento biológico envolvido na pigmentação cutânea, sendo determinante das diferenças na coloração da pele. O elemento inicial do processo biossintético da melanina é a tirosina, um aminoácido essencial. A tirosina sofre atuação química da tirosinase, complexo enzimático cúprico- proteico, sintetizado nos ribossomos e transferido através do retículo endoplasmático para o Aparelho de Golgi, sendo aglomerado em unidades envoltas por membrana, ou seja, os melanossomas (JIMBOW et al., 1999). Os três membros da família relacionada à tirosinase (tirosinase, Tyrp 1 – tirosinase relacionada à proteína 1 e Dct – dopacromo tautomerase) estão envolvidos no processo de melanogênese, levando à produção ou de eumelanina (marrom-preta) ou feomelanina (amarela-vermelha) (MURISIER; BEERMANN, 2006).
Em presença de oxigênio molecular, a tirosinase oxida a tirosina em dopa (dioxifenilalanina) e esta em dopaquinona. A partir desse momento, a presença ou ausência de cisteína determina o rumo da reação para síntese de eumelanina ou feomelanina (ITO, 2003). Na ausência de cisteína (glutationa), a dopaquinona é convertida em ciclodopa (leucodopacromo) e esta em dopacromo. Há duas vias de degradação de dopacromo: uma que forma DHI (dopa,5,6 diidroxiindol) em maior proporção e outra que forma DHICA (5,6 diidroxiindol-2-ácido carboxílico) em menor quantidade. Este processo é catalisado pela dopacromo tautomerase (Tyrp 2-Dct). Finalmente, estes diidroxindóis são oxidados à melanina (ITO, 2003).
A tirosinase relacionada à proteína 1 (Tyrp 1) parece estar envolvida na catalisação da oxidação da DHICA à eumelanina. Por outro lado, na presença de cisteína, a dopaquinona rapidamente reage com tal substância para gerar 5-S- cisteinildopa e, em menor proporção, 2-S-cisteinildopa. Logo, as cisteinildopas são oxidadas em intermediários benzotiazínicos e, finalmente, produzem feomelanina (Figura 8) (ITO, 2003)
Figura 8 – Esquema bioquímico da formação de eumelanina e feomelanina. Fonte: Sulaimon; Kitchell (2003).
Sendo assim, a melanogênese apresenta três passos distintos e importantes: o passo inicial é a produção de cisteinildopa, que continua tão intensa quanto for a quantidade de cisteína presente; o segundo passo é a oxidação da cisteinildopa para formar feomelanina – processo dependente da quantidade de cisteinildopa presente; o terceiro (e último) passo é a produção de eumelanina, que somente tem início após a maioria da cisteinildopa ser depletada. Entretanto, parece que a eumelanina se deposita sobre a feomelanina pré-formada e a relação entre feo e eumelanina é determinada pela atividade da tirosinase pele disponibilidade de cisteína (ITO, 2003).
O receptor de melanocortina do tipo 1 (MC1-R) controla a taxa de eumelanina e de feomelanina dentro dos melanossomas. Essa proporção representa um importante determinante da sensibilidade solar no ser humano. Entretanto, é provável que a quantidade total de melanina produzida seja ainda mais importante que a relação entre os tipos de melanina (JABLONSKI; CHAPLIN, 2000). Sabe-se que melanócitos, derivados de pele intensamente pigmentada, apresentam uma quantidade maior de melanina total e também uma taxa maior de eumelanina do que os melanócitos derivados de pele clara (ABDEL-MALEK et al., 2001).
A melanina total da pele resulta de uma mistura de monômeros de feomelanina e eumelanina, e a proporção entre as duas determina a expressão fenotípica final da cor da pele e dos cabelos (JIMBOW et al., 1999). A redução na eumelanina e a presença predominante de feomelanina, como nos indivíduos ruivos, são reguladas em grande parte pelo MC1-R JIMBOW et al., 1999).
Grânulos de melanina movem-se para os processos de melanócitos e são secretados para o espaço intercelular. Os queratinócitos próximos, por endocitose, capturam grânulos de melanina e ficam coloridos. O queratinócito colorido move-se para a superfície da pele, deixando-a. O número de melanócitos e melanina é geneticamente predeterminado e invariável. Mas, diferentes fatores externos e internos podem aumentar ou diminuir sua quantidade, modificando a síntese de melanina, que leva à discromia (LOPANDINA, 2018).
Após a síntese completa da melanina, os melanossomas, repletos desse pigmento, são injetados no interior dos queratinócitos, da unidade epidérmico- melânica correspondente, através dos prolongamentos dendríticos dos melanócitos. Uma vez no interior dos queratinócitos, os melanossomas tendem a se distribui no citoplasma sobre a parte superior do núcleo, de forma a protegê-lo das radiações ultravioleta. Tem sido sugerido que o pigmento, no interior destas células, atua, também, como varredor de radicais livres fotoproduzidos, sempre no sentido de proteger o DNA celular (BOISSY, 1988).
Cada indivíduo possui quantidade constitucional de melanina que pode aumentar como resultado de irradiação ultravioleta ou sob a influência de produção aumentada de determinados hormônios, sobretudo o hormônio melanócitos- estimulante (MSH) e o adrenocorticotrópico (ACTH) (RIVITTI; SAMPAIO, 2007).
A principal propriedade da melanina é a fotoproteção da radiação ultravioleta. Portanto, quanto mais RUV, mais ativa é a síntese da melanina. Os melanócitos produzem citocinas pró-inflamatórias: IL-1, IL-2, IL-6, IL-8, TNF-α, citocina anti- inflamatória IL-10, TGF-β, catecolaminas, eicosanoides e hormônio estimulante dos melanócitos (LOPANDINA, 2018).Os principais fatores reguladores para a quantidade e qualidade da melanina produzida pelos melanócitos incluem RUV (radiação ultravioleta), α-MSH (hormônio estimulante de melanócitos do tipo α ou melanocortina), ASP (proteína sinalizadora AGOUTI) e MC1-R ((SULAIMON; KITCHELL, 2003, ROUZAUD; HEARING, 2005).
2.1.1.3 α-MSH e MC1-R
Em 1967, Snell sumarizou o prevalente consenso acerca da ação hormonal nos melanócitos de mamíferos, particularmente em humanos (SLOMINSKI, 2004; KLAUS; SNELL, 1967). A síntese de melanina sofre intenso controle hormonal: a proopiomelanocortina (POMC) é sintetizada pela glândula pituitária e responsável pela origem de vários subprodutos, dentre eles o α-MSH (LIN; FISHER, 2007).
Injeções de α-MSH e β-MSH nos indivíduos humanos levaram a um escurecimento da pele, resultando na elevada melanogênese dentro dos melanócitos epidérmicos e aumentando o transporte dos melanossomas, derivados de melanócitos, para os queratinócitos, sem a necessidade de exposição a RUV. A hiperpigmentação cutânea foi também observada quando indivíduos humanos foram injetados com altas doses de hormônio adrenocorticotrópico (ACTH) (JIMBOW et al., 1999, SLOMINSKI, 2004; BARSH; ATTARDI, 2007; WICKELGREN, 2007).
Queratinócitos humanos são capazes de sintetizar α-MSH e β-MSH em quantidades fisiológicas, e o – MSH é também produzido em melanócitos e células de Langehans (LIN; FISHER, 2007); JIMBOW et al., 1999; ROUZAUD et al., 2005; ROUZAUD; HEARING, 2005). Evidências indicam que estes hormônios têm um papel parácrino, na regulação das funções dos melanócitos. Mais de 120 genes têm sido identificados e parecem regular a pigmentação, porém, os efeitos do α-MSH são mediados pelo MC1-R (receptor de melanocortina 1), o qual é expresso na superfície dos melanócitos, sendo considerado o ponto-chave para a pigmentação, estando também presente em outras células, tais como: monócitos, neutrófilos, células de glioma, astrócitos, macrófagos, fibroblastos, células endoteliais e queratinócitos. Desde que o MC1-R tenha uma distribuição tecidual ampla, é provável que esteja associado com um número grande de funções biológicas (LIN; FISHER, 2007; JIMBOW et al., 1999; ROUZAUD et al., 2005; ROUZAUD; HEARING, 2005).
O α-MSH sinaliza, através do MC1-R, ativando a adenilciclase (AC) e aumentando a adenosina monofosfato cíclico (AMPc) intracelular, resultando em produção do pigmento escuro de eumelanina. Se o MC1-R está envolvido em outras vias sinalizadoras, ainda permanece desconhecido, mas a ativação do MC1-R influencia as quantidades relativas de feomelanina e eumelanina produzidas, sendo sua perda de atividade associada a cabelos vermelhos ou amarelos (THODY; GRAHAM, 1998; VOISEY; CARROLL; VAN DAAL, 2003; REES, 2000; TAN et al., 1999; HA; REES, 2001).
Figura 9 – Esquema da sinalização do α-MSH via MC1-R, resultando na formação de eumelanina e feomelanina. Fonte: Thody; Graham (1998). 2.1.1.4 RUV (Radiação Ultravioleta) e Pigmentação
Os efeitos agudos da exposição à RUV podem ser, basicamente, dois: queimadura e/ou bronzeamento. A resposta do indivíduo à exposição à RUV, ou seja, o quanto consegue de bronzeamento, é um dos maiores exemplos de adaptação ambiental dos humanos (LIN; FISHER, 2007).
Após uma única exposição à RUV, um aumento no tamanho dos melanócitos pode ser observado, acompanhado de um aumento da atividade da tirosinase. Exposições repetidas à RUV levam a um aumento no número de melanossomas, estágio IV, transferidos aos queratinócitos, bem como a um aumento no número de melanócitos ativos. Além disso, a densidade dos melanócitos, em estudos comparativos, é maior nas áreas fotoexpostas (BOLOGNIA; ORLOW, 2003).
A radiação ultravioleta B (UVB), na pele humana, induz a produção de α-MSH e ACTH nos melanócitos e queratinócitos. O α-MSH estimula a atividade da tirosinase e a síntese de melanina in vivo e em cultura de melanócitos, via MC1-R. Outros relatos indicam que a irradiação de melanócitos com RUV aumenta os níveis de RNAm de MC1-R. Além disso, a síntese de muitos fatores epidérmicos, incluindo α-MSH, ACTH e endotelina-1, é aumentada pela exposição a RUV, sugerindo uma importante influência desses mediadores na resposta dos melanócitos à luz solar (ABDEL-MALEK et al., 2000; FUNASAKA et al., 1998; BOHM et al., 1999).
A interação dos hormônios e da RUV pode ser ilustrada no melasma. A RUV estimula a produção de melanocortina, dentro dos melanócitos e queratinócitos, o que justifica o envolvimento desse hormônio na patogênese do melasma, posto que se caracteriza basicamente por uma melanização epidérmica aumentada, sem proliferação melanocítica (JIMBOW et al., 1999).
2.2 DERME
A derme está localizada entre a epiderme e a hipoderme, formando uma conexão suficientemente móvel com elas através de estruturas fibrosas do tecido conjuntivo, que é um sistema complexo com grande número de ligações, cada uma delas controladas por genes específicos (LOPANDINA, 2018).
A derme é composta por uma substância intercelular amorfa-matriz, fibras e estruturas celulares. A rede fibrosa consiste em proteínas estruturais – colágeno, elastina e reticulina. As estruturas celulares básicas da derme são formadas por fibroblastos, macrófagos, mastócitos e melanócitos. Todavia, na derme também existem outros tipos de células: leucócitos, eosinófilos, linfócitos, células dos nervos, vasos sanguíneos e apêndices da pele (LOPANDINA, 2018).
2.3 HIPODERME
A gordura subcutânea na face está sujeita a variações significativas, dependendo do sexo, da idade e do contexto constitucional e étnico. O tecido adiposo subcutâneo está localizado diretamente abaixo da derme e tem uma conexão frouxa com ela. O tecido adiposo subcutâneo é um tipo de tecido conjuntivo que inclui um conjunto completo de componentes do tecido conjuntivo: partes celulares, estroma conectivo e sistema vascular. (LOPANDINA, 2018).
3. O MELASMA
Segundo a Sociedade Brasileira de Dermatologia, o melasma é caracterizado pelo surgimento de manchas escuras na pele, mais comumente na face, contudo, também pode acometer braços, pescoço e colo. O melasma é caracterizado pelo aumento da deposição de melanina e, possivelmente, pelo aumento do número de melanócitos na epiderme. Geralmente, essa hiperpigmentação se apresenta de forma bilateral e simétrica, com formato irregular e bem definido, como máculas cutâneas marrons ou acinzentadas que medem de poucos milímetros a mais de dois centímetros de diâmetro. Essas lesões não possuem potencial de transformação maligna.
Tal condição apresenta maior incidência em mulheres, apesar da causa exata ainda ser desconhecida, mas acredita-se que a exposição à luz ultravioleta, predisposição genética e influências hormonais sejam fatores etiológicos importantes e desencadeantes dessa patologia.
O melasma, em muitas vezes, está associado à gravidez, uso de contraceptivos orais, terapia de reposição hormonal, doenças da tireoide, medicações fototóxicas, agentes antiepilépticos, além da excessiva exposição ao sol. Vários estudos sugerem uma predisposição genética mais comum em indivíduos de pele escura, particularmente, mulheres asiáticas e hispânicas. Essas lesões aparecem em indivíduos adultos e se desenvolvem de forma lenta com a exposição solar e primariamente envolvem a pele do terço médio da face, testa, lábio superior, queixo, região do ramo mandibular e raramente os braços. A pigmentação pode permanecer fraca ou escurecer com o tempo, assim como pode desaparecer após o parto ou a descontinuidade de um contraceptivo oral.
Figura 10 – Imagem esquemática de um melanócito.
O melasma, anteriormente conhecido como cloasma, é uma doença pigmentar adquirida, ocorrendo mais comumente na face. Esse distúrbio, que é mais prevalente em mulheres e nos tipos de pele mais escura, é atribuído predominantemente à exposição aos raios ultravioleta (UV) e às influências hormonais (SANCHEZ et al., 1981).
Não há um consenso sobre a classificação clínica do Melasma, sendo reconhecidos dois principais padrões de melasma da face: centrofacial, porque acomete a região central da fronte, região bucal, labial, região supralabial e região mentoniana; e malar, que acomete regiões zigomáticas. Alguns autores acrescentam ainda um terceiro padrão, menos frequente, chamado mandibular. Ponzio & Cruz (1993) observaram em um estudo 78,7% de melasmas centrais e 21,3% de periféricos (SANCHEZ et al., 1981; PONZIO, 1995; PONZIO; CRUZ, 1993).
Figura 11 – Fotos clinicas de pacientes com melasma, demonstrando as principais topografias acometidas. * A. Glabelar, zigomatico e nasal. B. Frontal e zigomatico. C. Glabelar, zigomatico, labial superior e mentoniano. Fonte: Fisiologia do Melasma (artigo).
O melasma é caracterizado por máculas acastanhadas, mais ou menos escuras, de contornos irregulares e limites nítidos, que afeta áreas fotoexpostas da pele, sendo mais comum em mulheres; estudos relataram que os homens representam 10% dos casos (NICOLAIDOU; KATSAMBAS, 2014). Muitas mulheres desenvolvem esta condição durante a gestação e, e em alguns casos, desaparece após o parto, em outras não (STEINER et al., 2009a).
Figura 12 – Tecido com Melasma. Fonte: slidesshare.net.
3.1 TIPOS DE MELASMAS
A literatura descreve três tipos de melasmas: epidérmico, dérmico e misto, conforme o local de depósito deste pigmento. A maioria dos casos possui padrão misto.
No tipo epidérmico, há aumento do pigmento em todas as camadas da epiderme, principalmente nas camadas basal e suprabasilar. Os melanócitos na epiderme são geralmente aumentados, têm dendritos proeminentes e melanossomas aumentados (GRIMES; YAMADA; BHAWAN, 2005; KANG et al., 2002). Embora um estudo tenha sugerido um aumento no número de melanócitos, a maioria dos estudos não relatou nenhuma mudança no número de melanócitos epidérmicos (KANG et al., 2002).
A pigmentação epidérmica pode ser acentuada com uma lâmpada de Wood, que pode ajudar a distinguir os subtipos epidérmico e dérmico; o subtipo dérmico possui melanófagos na derme superficial e profunda e, além disso, um infiltrado linfo-histiocitário pode ser visto na derme em áreas com aumento da deposição de melanina. Os achados dérmicos também podem incluir elastose solar e aumento dos vasos sanguíneos (GRIMES; YAMADA; BHAWAN, 2005; BAGHERANI; GIANFALDONI; SMOLLER, 2015). O melasma misto geralmente exibe características histológicas combinadas dos subtipos epidérmico e dérmico.
3.2 O MELASMA E O IMPACTO NA VIDA DO PORTADOR
Um fato bem documentado na literatura, é que o melasma tem um profundo impacto na qualidade de vida de seu portador (PURIM; AVELAR, 2012; IKINO, 2013). No estudo realizado por Purim e Avelar, em 2012, com 109 puérperas portadoras de melasma, houve predominância (60,6%) de mulheres de pele clara, distribuídas, segundo a classificação de Fitzpatrick, em fototipo III, sendo que 73,4% não fazia uso de protetor solar, observou, ao analisar o escore MelasQol, que a aparência da pele, frustração e constrangimento foram os itens que receberam uma maior pontuação, indicando o grau de incômodo causado pela dermatose. A atenção a esse fato pode ser importante para minimizar a ansiedade puerperal (PURIM; AVELAR, 2012).
No estudo de Ikino (2013), em que se utilizou a análise do MelasQol, observou-se que 94,11% dos pacientes sentem-se incomodados com a aparência de sua pele, 64,71% sentem frustração ou constrangimento pela condição de sua pele, 52,94% sentem-se depressivos e 78,43% têm a sensação de não serem atraentes (IKINO, 2013).
3.3 ETIOLOGIA DO MELASMA
No tocante à etiologia do melasma, a literatura descreve os fatores que podem influenciar o seu aparecimento como genéticos, hormonais, ambientais e étnicos. Os fatores genéticos e os étnicos contribuem bastante para a patologia da doença, fato comprovado pela alta incidência do melasma entre pessoas da mesma família e pelo fato de a dermatose ser mais comum entre latinos (NEUMANN, 2011).
A origem da hiperpigmentação está relacionada à elevação sérica dos hormônios melanotróficos, estrogênio e, possivelmente da progesterona, especialmente no terceiro trimestre da gestação. Os níveis hormonais de estrógeno e progesterona estão modificados nestas situações e trabalhos atuais demonstraram receptores específicos para o estradiol em cultura de melanócitos; o estrógeno ou a progesterona isoladamente não parece provocar o mesmo tipo de estímulo. O nível de hormônio melanotrófico é normal nos pacientes com melasma (NEUMANN, 2011).
O fator ambiental mais importante para o desenvolvimento do melasma é a exposição à luz solar. Nos homens, este fator está relacionado também à predisposição familiar. A radiação ultravioleta pode causar peroxidação dos lipídios nas membranas das células, levando ao surgimento dos radicais livres, estimulando os melanócitos a produzirem, em excesso, melanina (NEUMANN, 2011). Pacientes com melasma também apresentam marcadores mais elevados de estresse oxidativo quando comparados a voluntários saudáveis (SECKIN et al., 2014).
Outros fatores relacionados com o surgimento do melasma são a gravidez e os hormônios exógenos, isto é, contraceptivos orais e terapia de reposição hormonal (NICOLAIDOU; KATSAMBAS, 2014), além do uso de cosméticos e de certas medicações, como anticonvulsivantes, substâncias fotossensibilizantes (PANDYA; GUEVARA, 2000), disfunção da tireoide (HABIF, 2012) e endocrinopatias (MIOT et al., 2009).
3.4 MANIFESTAÇOES CLÍNICAS
No tocante às manifestações clínicas do melasma, estas iniciam-se após a puberdade, geralmente entre os 20 e 30 anos de idade, surgindo de forma súbita ou gradualmente, e destacam-se manchas simétricas e hiperpigmentadas em áreas fotoexpostas, acometendo principalmente a face, pescoço, colo e braços.
A pigmentação é macular, mal delimitada e de coloração marrom-clara ou mais escura, dependendo da exposição recente à luz solar (DU VIVIER, 2004). As manchas variam de acordo com o fototipo do paciente e da quantidade de depósito de melanina, sendo que as mais recentes se tornam intensamente escurecidas, ainda que as antigas não tenham o mesmo comportamento. Podem, ainda, hiperpigmentarem a fronte, o nariz, a axila, a parte interna das coxas, o períneo, as sardas e os nevos. (AZULAY; AZULAY, 2000).
3.5 DIAGNÓSTICO
Morfologicamente, o melasma se apresenta como manchas hiperpigmentadas reticuladas simétricas com bordas irregulares na região centrofacial, bochechas malar, mandíbula e, raramente, tórax superior e extremidades. Embora seja conhecido por afetar mais comumente os tipos de pele mais escura, pode ocorrer em todos os tipos de pele (GUINOT et al., 2010; TAMEGA et al., 2013; HEXSEL et al., 2014). No exame dermatoscópico, é possível observar a hiperpigmentação pronunciada nas cristas da pele (MISHRA et al., 2013): usando uma lâmpada de Wood, a hiperpigmentação pode ser acentuada quando o pigmento é epidérmico (ACHAR; RATHI, 2011), mas essa acentuação pode ser observada com melasma dérmico ou misto (SANCHEZ et al., 1981; GRIMES; YAMADA; BHAWAN, 2005).
Na realização do diagnóstico, conta-se com a observação do quadro clínico, sendo os exames laboratoriais dispensados. Não há qualquer tipo de sintoma ou acometimento de mucosas relacionado com a doença (NEUMANN, 2011). O diagnóstico diferencial deve ser feito entre hiperpigmentação pós-inflamatória, nevo adquirido bilateral similar ao nevo de Ota, hiperpigmentação periorbitária, eritrose peribucal pigmental de Brocq, eritromelanose folicular facial, lentigo simples, efélides, melanoses solares, melanose de Riehl e líquen plano actínico (PANDYA; GUEVARA, 2000), doença de Addison, fotossensibilidade induzida por drogas, lúpus eritematoide discoide, mastocitose, poiquilodermia de Civatte (AZULAY; AZULAY, 2000), pigmentação relacionada com hipertireoidismo, pigmentação por ingestão de hidantoína, pigmentação relacionada à infecção por HIV (vírus da imunodeficiência humana) e dermatite cosmética pigmentada. A dermatite cosmética pigmentada apresenta pigmentação cinza-amarronzada a marrom avermelhada, que frequentemente se dá pela redução do pigmento epidérmico (HABIF, 2012). Salienta-se que o melasma não deve ser visto apenas como um distúrbio orgânico: o paciente precisa ser avaliado na sua totalidade, levando-se em consideração a exposição solar, a história genética, o uso de terapias hormonais, as comorbidades e o impacto que a doença pode ter na sua vida social (MATOS; CAVALCANTI, 2009).
3.6 FISIOPATOLOGIA DO MELASMA
A pigmentação da pele ocorre pela ação da melanina. Esta é produzida pelos melanócitos a partir da tirosina (formando eumelanina) ou da tirosina e cisteína (formando feomelanina) pela ação da tirosinase. É a ativação do receptor de melacortina 1 (MCR1) que promove essa diferenciada transformação. A transferência da melanina para os queratinócitos é feita pelo melanócito ou pela unidade epidérmica de melanização. A ação do hormônio melanoestimulante (MSH) promove aumento dos melanócitos e entra nas células pela ação de receptores. A exposição aos raios ultravioletas (RUV) promove um aumento dos números de melanócitos. São quatro a seis genes que determinam a cor da pele e isso justifica os diferentes tipos de coloração. A classificação da pele pode ser dividida em seis fototipos, indo de branco, morena a negra (GUIRRO; GUIRRO, 2004).
Como citado anteriormente, o melasma é uma patologia que pode causar impacto negativo na vida das pessoas por sua hiperpigmentação inestética. Estudos comparativos entre a pele hiperpigmentada e a pele sã desses pacientes, assim como estudos com mulheres pós-menopausa, gestantes e homens, seriam de grande ajuda para a formação de hipóteses sobre sua fisiopatogenia e para a escolha de tratamentos adequados (MIOT et al., 2009).
A etiologia do melasma é multifatorial. A luz ultravioleta foi mostrada em estudos clínicos e laboratoriais para desencadear e exacerbar a condição (ACHAR; RATHI, 2011).Acredita-se que a luz ultravioleta induza espécies reativas de oxigênio (ROS), ativando o óxido nítrico indutível e promovendo a melanogênese (JO et al., 2009). Pacientes com melasma também apresentam marcadores mais elevados de estresse oxidativo quando comparados a voluntários saudáveis (SECKIN et al., 2014). Mais recentemente, o papel da luz visível na indução da pigmentação foi apreciado: um estudo seminal mostrou pigmentação sustentada da luz visível em tipos de pele mais escura ao longo de duas semanas em comparação com a pigmentação da luz UVA-1 (MAHMOUD et al., 2010). Outro estudo mostrou que a luz visível em um comprimento de onda de 415 nm pode causar aumento da pigmentação que pode durar três meses (DUTEIL et al., 2014).
O histórico familiar também é conhecido por ser um importante fator de risco para o desenvolvimento do melasma, reforçando a hipótese de uma predisposição genética para o quadro. Alguns estudos relataram que 55-64% dos pacientes com essa condição têm uma história familiar positiva (MOIN; JABERY; FALLAH, 2006; ADALATKHAH et al., 2008; HANDEL et al., 2014). Nenhum estudo do genoma foi realizado para examinar os genes associados, mas as descobertas atuais sugerem que os genes responsáveis envolvem respostas pigmentares, inflamatórias, hormonais e possivelmente vasculares. Pacientes com tipo de pele Fitzpatrick (FST) II e III são menos propensos a ter uma história familiar positiva do que pacientes com tipos de pele mais escura (IV-VI) (HEXSEL et al., 2014; ORTONNE et al., 2009).
As influências hormonais desempenham um papel significativo na patogênese do melasma, conforme visto pelo aumento da prevalência com a gravidez, uso de anticoncepcionais orais e outras terapias hormonais (GUINOT et al., 2010; TAMEGA et al., 2013; HANDEL et al., 2014; ORTONNE et al., 2009. O melasma extrafacial também foi associado a um estado de perimenopausa (RITTER et al., 2013; HEXSEL et al., 2014).
Um estudo imuno-histoquímico da epiderme e derme da pele afetada e não afetada encontrou um aumento significativo da expressão do receptor de progesterona na epiderme da pele afetada (JANG et al., 2010). Também houve aumento da expressão da proteína receptora de estrogênio na derme e ao redor dos vasos sanguíneos, o que atualmente é de significado desconhecido (TÂMEGA et al., 2015).
3.7 PREVENÇÕES PARA O MELASMA
A maior prevenção para o melasma é a proteção solar, isso significa que toda e qualquer medida para evitar a exposição da região acometida deve ser estimulada, seja com bloqueadores e filtros solares ou barreiras físicas, independentemente da condição climática do dia, nublado ou chuvoso.
Como a hiperpigmentação da pele também é causada por luz visível, o uso de roupas, chapéus, bonés, óculos escuros, sombrinhas e guarda-sóis é recomendado, já que somente o filtro solar, o qual deve conter óxido de zinco ou dióxido de titânio em sua formulação, mesmo que reaplicado de forma constante, não é suficiente para proteção.
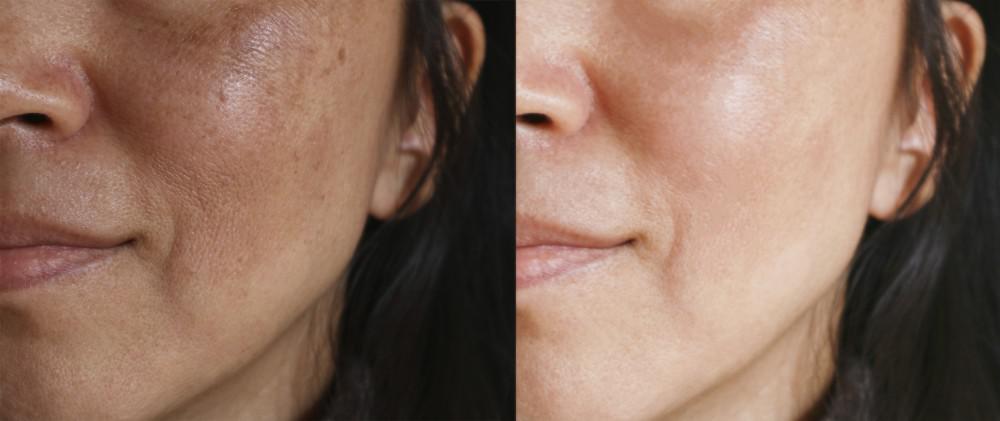
4. TRATAMENTOS DO MELASMA
Em função de sua etiologia, o melasma apresenta um tratamento relativamente difícil. Seu diagnóstico correto possibilita a escolha de um tratamento, que geralmente é um conjunto de várias técnicas, buscando-se medidas para clarear, estabilizar e impedir o retorno da mácula. A colaboração do paciente é imprescindível para o sucesso do tratamento, que necessita de uma rotina rígida de cuidados.
Apesar de existirem vários tratamentos disponíveis, a orientação de proteção contra o sol ou fotoproteção é indispensável, e esse cuidado deve ser redobrado ao início de qualquer tratamento. Dentre os mais utilizados, os peelings químicos, físicos e lasers reduzem a camada córnea, renovando a pele e clareando as lesões. Juntamente a eles, é indispensável o uso de produtos diários com ativos despigmentantes, que atuem diretamente sobre a enzima tirosinase para redução da produção de melanina, aumentando as chances de sucesso no tratamento escolhido.
Os peelings, físicos ou químicos, causam um clareamento gradual da pele e podem ser superficiais, considerados mais seguros, ou que atinjam camadas mais profundas da pele. Dependendo do caso, podem apresentar resultados mais rapidamente do que os cremes. O uso de laser e luz intensa pulsada também podem ajudar no conjunto de medidas do tratamento para clarear a lesão, embora essa técnica possa gerar mais pigmentação, se mal aplicada.
Além dos citados, existem os cremes como um dos cuidados indicados para a complementação dos tratamentos feitos pelo paciente em sua própria casa, os mais usados são à base de hidroquinona, ácido glicólico, ácido retinóico e ácido azelaico, e outros ativos utilizados são arbutin, ácido kójico, ácido fítico, ácido tranexâmico e ácido dioico. E, por fim, o mesolift com PRP autólogo, estimulando os fatores de crescimento para um tecido de preenchimento livre de lesões. O procedimento é rápido e seguro e não apresenta contraindicações. Demais opções de tratamento:
- Plasma Rico em Plaquetas;
- Agentes tópicos despigmentantes;
- Microagulhamento;
- Peelings químicos;
- Luz intensa pulsada;
- Lasers e luz pulsada;
- Fotoproteção;
- Corticosteroides;
- Terapia Oral;
- Radiofrequência;
- LED Ambar.
O tratamento do melasma é geralmente insatisfatório, pela grande recorrência das lesões e pela ausência de uma alternativa de clareamento definitivo. Estudos clínicos controlados indicam a fotoproteção e uso de clareadores como as medidas de primeira linha no seu tratamento (PANDYA et al., 2006; HEXSEL; ARELLANO; RENDON, 2006).
O manejo do melasma continua sendo um desafio para a área médica. O tratamento tem se concentrado na identificação dos fatores-chave na síntese da melanina. Alguns dos tratamentos incluem alternativas tópicas, como o uso de retinoides, hidroquinona, ácido azelaico, arbutina, ácido kójico, ácido ascórbico e corticosteroides, mas tudo isso pode causar irritação na pele como efeito colateral. Alternativas orais como ácido tranexâmico e glutationa também são usados, mas podem levar a distensão abdominal, distúrbios do ciclo menstrual, dor de cabeça e até trombose venosa profunda (OGBECHIE‐GODEC; ELBULUK, 2017; RODRIGUES; PANDYA, 2015). Estudos recentes mostram que o uso de terapias como peelings químicos, terapias baseadas em tecnologia de laser e a microdermoabrasão podem ser eficazes, mas podem ter efeitos colaterais que variam de eritema a queimaduras (OGBECHIE‐GODEC; ELBULUK, 2017).
O uso do PRP é proposto como um tratamento alternativo, que mostra efeitos colaterais mínimos que estão principalmente associados à sua injeção (marcas transitórias após a injeção). PDGF (fator de crescimento derivado de plaquetas) está relacionado aos resultados positivos obtidos com o tratamento PRP, pois confere papel importante na angiogênese, síntese de colágeno e componentes da matriz extracelular. Portanto, o efeito do PRP atinge o reparo de tecidos agindo sobre os diferentes tipos de células que são localizados na pele, promovendo sua proliferação e diferenciação (ÇAYIRLI et al., 2014).
4.1 O PLASMA RICO EM PLAQUETAS
O plasma rico em plaquetas (PRP) tem suas origens na década de 1980, quando Helena Matras descreveu o uso de cola de fibrina como uma substância com funções vedantes que ajudaram a reparar o tecido em várias vias orais e procedimentos cirúrgicos maxilofaciais (MATRAS, 1982). . Mais tarde, em 1986, Marx incorporou PRP no gel usado em cirurgia maxilofacial para a colocação de osso (MARX et al., 1998). Desde esses primeiros estudos, o PRP tornou-se um interesse crescente nos campos clínicos e de pesquisa, como medicina do esporte, especialidades odontológicas, ginecologia, ortopedia, cirurgia plástica, otorrinolaringologia, neurociências, entre outros (ALCARAZ‐RUBIO; OLIVER‐ IGUACEL; SÁNCHEZ‐LÓPEZ, 2015; LACCI; DARDIK, 2010).
4.1.1 Plaquetas e fatores de crescimento
O tecido hematopoiético é formado pelo conjunto de sangue periférico e medula óssea. O sangue é constituído por elementos figurados e pelo plasma, o qual corresponde ao líquido intercelular, conferindo ao sangue suas propriedades líquidas. Há ainda os eritrócitos, leucócitos e plaquetas, correspondentes aos elementos celulares. Após a separação do sangue, forma-se na parte superior da camada celular outra camada mais delgada, chamada de creme ou papa leucocitária (buffy coat), constituída por leucócitos e plaquetas (MACEDO, 2004; ANDRADE; DANTAS; SADIGURKSY, 2007).
As plaquetas são pequenos fragmentos citoplasmáticos, anucleados, derivados de células da medula óssea denominadas de megacariócitos. Na formação das plaquetas, minúsculas porções do citoplasma separam-se das regiões periféricas dos megacariócitos através de grandes canais de demarcação plaquetária. 80% das plaquetas estão sempre circulando e 20% estão concentradas no baço. As plaquetas participam ativamente no processo de reparo das feridas, sendo as primeiras células presentes no local do trauma. Um megacariócito pode originar duas a três mil plaquetas (BAIN, 2007).
É importante abordar que é através das citocinas que regulam a resposta imunoinflamatória do organismo, fenômeno conhecido como comunicação celular, que os fatores de crescimento têm sua função de auxiliar na regeneração dos tecidos (GOLDMAN; BENNETT, 2001). Sendo assim, as plaquetas conseguem excretar variados tipos de fatores de crescimento (LINS et al., 2010): fator de crescimento derivado das plaquetas (Platelet derivated growth factors – PDGF), fator transformador do crescimento β (transforming growth factors – TGF-β), fator de crescimento semelhante à insulina (insulin-like growth factor 1), fator de crescimento endotelial vascular (vascular endothelial growth factor – VEGF); fator de crescimento epitelial (epithelial growth factor – EGF); fator de angiogênese derivado da plaqueta (platelet-derived angiogenesis factor) e fator plaquetário 4 (platelet factor 4 – PF-4) (DUSSE et al., 2008).
O fator PDGF foi identificado como um agente mitogênico para células mesenquimais presentes no soro sanguíneo de macacos e camundongos, componente este presente na família relacionada aos fatores de crescimento vasculares (BRITO, 2010).
O PDGF é o principal responsável pelo aparecimento no local da lesão e atua sobre a regeneração, formado por um grande número de polipeptídeos, alguns dos quais atuam nos muitos tipos celulares e outros com alvos celulares restritos (BRITO, 2010; PONTUAL; MAGINI, 2004).
As plaquetas, estruturas anucleadas que circulam no sangue periférico, possuem uma semivida de sete a dez dias e contêm no seu citoplasma estruturas (grânulos-alfa) com uma grande concentração em proteínas. O aumento de sua produção resulta na proliferação e diferenciação celular e no aumento da produção da matriz extracelular, ajudando também na coagulação sanguínea. Outros tipos de fatores de crescimento também podem ser liberados conjuntamente com o PDGF, como o TGF- β, o PF-4 e a b-tromboglobulina, induzindo desta maneira a quimiotaxia de células no local da lesão (PONTUAL; MAGINI, 2004). Eles são a chave para regular diversos eventos celulares, tais como: síntese de DNA, quimiotaxia, efeito analgésico, citodiferenciação e síntese de matriz óssea (SILVA, 2010).
A síntese do PDGF é realizada por vários tipos celulares, incluindo fibroblastos, macrófagos, monócitos, células endoteliais, miofibroblastos e até mesmo queratinócitos (LINS et al., 2010). O PDGF é muito importante pelo fato de ser o primeiro componente a estar presente no local da lesão, guiando diversos fatores para a possível regeneração do local lesionado. Quando ativo, inicia sua função, atingindo as células-alvo, aderindo aos receptores da membrana celular e estabelecendo suas ligações, como é o caso da tirosina-quinase. Sua estrutura é dimérica, tendo dois sítios de ligação ao receptor, permitindo a união com receptores adjacentes, iniciando o processo de sinalização celular (UEBEL, 2006); desta forma, os receptores-alfa ligam-se às cadeias A e B, enquanto os receptores-beta ligam-se somente às cadeias B. Conclui-se que, possivelmente, por esse motivo, a cadeia A tenha um papel de maior importância durante as fases iniciais do reparo que a cadeia B. Assim, o posterior aumento de suas concentrações nesses sítios acelera o processo de reparo (PONTUAL; MAGINI, 2004).
Alguns estudos específicos identificaram uma lista completa desses fatores, dentre os quais três são mais importantes, isto é, dos grânulos-alfa plaquetários: PDGF, TGF- βs, IGF-I. Ainda é necessário saber que existem outros tipos e citocinas envolvidos na regeneração e na cicatrização de feridas, os quais estão elencados na Tabela 1, a seguir (COSTA; SANTOS, 2016).
Tabela 1 – Crescimento e citocinas envolvidos na regeneração tecidual. Fonte: Costa; Santos (2016).
4.1.2 Definição do PRP
O Plasma Rico em Plaquetas, conhecido pela sigla PRP, é um procedimento bioestimulador, sendo uma das possibilidades apresentadas pela HOF para rejuvenescimento, atenuação de manchas e linhas de expressão. Além disso, devido às suas propriedades cicatrizantes, o PRP também é utilizado em cirurgias de implantes, fechamento de feridas cirúrgicas, preenchimento de alvéolos frescos, regeneração óssea guiada, proteção e cicatrização de feridas cutâneas, preenchimentos de papilas e estimulação de enxertos ósseos, colaborando para evitar dor pós-operatória e para o sucesso de todos esses procedimentos.
O PRP é um conglomerado de células com alto potencial regenerativo, aumentando a produção de colágeno tipo I e elastina, deixando a pele mais firme, nutrida e com aspecto jovial, no período aproximado de quinze meses, seguindo o protocolo correto de aplicações e tratamento. Assim, as plaquetas contidas no plasma processado e injetado possuem fatores de crescimento responsáveis pelo recrutamento de células-mãe periféricas que estimulam as mitoses celulares, causando uma “autorregeneração” do DNA celular de forma natural. Apesar de o plasma ser reabsorvido rapidamente, os fatores de crescimento plaquetário permanecem e estimularão o crescimento de um tecido de preenchimento autólogo de forma rápida e segura.
O Plasma Rico em Plaquetas (PRP) é definido como um produto biológico autólogo derivado do sangue do paciente e do qual, após um processo de centrifugação, é obtida uma fração plasmática com uma concentração de plaquetas maior que a do sangue circulante (CHICHARRO-ALCÁNTARA et al., 2018). Ele contém substâncias bioativas, incluindo fatores de crescimento, capazes de acelerar o processo de regeneração dos tecidos (ARAKI et al., 2012). O PRP é um produto autólogo derivado do sangue com concentração moderada de plaquetas e poucos leucócitos, evitando os efeitos pró-inflamatórios das proteases e hidrolases ácidas contido nas células brancas do sangue (ANITUA, 1999).
4.1.3 Ação do PRP e sua aplicação clínica
O PRP tem um papel na bioestimulação de fibroblastos da pele, imitando a cascata de coagulação. É aqui que o fibrinogênio é convertido em fibrina pela trombina, formando o coágulo necessário para atingir a homeostase, solicitando a liberação de proteínas para o reparo do tecido. Assim, a cura do processo de tecidos lesados é acelerado, devido à sua alta concentração de fatores de crescimento (GF) (EPPLEY; WOODELL; HIGGINS, 2004; SCHMITZ; HOLLINGER, 2001).
A aplicação do PRP, nos estudos publicados na literatura, varia em vários cenários clínicos envolvendo tratamentos de pele, ossos, odontológicos, cirurgias maxilofaciais, pé e perna diabética, cirurgia cardíaca e vascular, lesões timpânicas, oculares e córneas, lesões de nervos, fusão espinhal, queimaduras, cirurgia estética e lifting. Na maior parte destes estudos foram demonstrados resultados positivos e encorajadores. Apesar das evidências sobre os mecanismos biológicos que sustentam a eficácia clínica do gel de plaquetas, deve-se considerar que o aspecto técnico da preparação do PRP está estreitamente relacionado a seus efeitos clínicos. Logo, a falta de padronização da técnica de preparação do PRP em diferentes estudos pode estar relacionada à falta de eficácia encontrada por alguns autores (BORZINI; MAZZUCCO, 2007).
A Odontologia vem se destacando no uso do gel de plaquetas e tem acumulado grande experiência nesta área. O conhecimento dessa área pode servir de marco para a utilização em outras áreas, pois, como já exposto, tal procedimento não é prejudicial à saúde do paciente, pois é elaborado de forma segura com base em material fornecido pelo próprio indivíduo que será submetido ao tratamento com PRP (DUSSE et al., 2008). Um estudo retrospectivo das publicações sobre o uso do PRP na Odontologia foi desenvolvido por Carlson e Roach, sendo constatado que o uso do PRP foi benéfico para o reparo tecidual envolvido (ANITUA; ORTIZ, 2000).
Originários do sangue, os diversos tipos de PRP possuem muitos componentes e substâncias bioativas que desempenham funções variadas nos processos de recuperação dos tecidos. Levando-se em consideração a importância para a medicina regenerativa, pode-se destacar os três principais componentes do PRP, que são as plaquetas, o plasma e os leucócitos. Cada um destes componentes possui suas substâncias bioativas (BOSWELL et al., 2012).
Segundo a Sociedade Brasileira de Cirurgia Plástica (SBCP, 2017) o PRP é uma novidade terapêutica que consiste em aplicar as próprias proteínas de crescimento celular do paciente em diferentes áreas do corpo para favorecer seu rejuvenescimento. Os fatores de crescimento derivados das plaquetas estimulam de maneira potente a regeneração e reprodução celular por serem muito úteis em tratamentos de rejuvenescimento facial, oferecendo assim uma cútis renovada, hidratada, com boa elasticidade. É útil também como coadjuvante nas lipoenxertias faciais ou de glúteos ou como cicatrizante após cirurgias de abdômen ou mama (VIEIRA, 2011).
O PRP, agente bioativo que vem sendo utilizado nas últimas décadas como uma nova opção terapêutica em diversos distúrbios dermatológicos, utilizada como o único tratamento, e em outros casos, como uma ferramenta adjuvante, mostrando efeitos positivos na reparação do tecido estrutural e em níveis funcionais. Embora, para a obtenção do PRP, diversos protocolos tenham sido criados, é claro que fatores como a força e número de centrifugações e o método usado para ativar as plaquetas influencia a qualidade do PRP, que pode estar relacionada à variedade de resultados obtidos. Vários estudos demonstram o papel potencial do PRP na área de dermatologia. Os resultados permitem concluir que este tratamento leva a uma taxa mais rápida de reparo de tecidos e à proliferação de queratinócitos e fibroblastos, bem como um melhor colágeno e produção de elastina e geração de tecido de granulação, com poucos efeitos adversos porque é bem tolerado (MERCHÁN et al., 2019).
4.1.4 Processamento do PRP
Esse procedimento requer a coleta do sangue do próprio paciente por venopunção, que passará por um uma centrifugação, onde ocorrerá a separação de um concentrado de fatores de crescimento. Esse material será injetado na pele do paciente, estimulando a regeneração. Portanto, esta técnica consiste em regeneração tecidual guiada, realizada com o sangue autólogo.
Figura 13 – Procedimento.
O PRP é um produto de sangue autólogo (sangue do próprio paciente) que é processado por centrifugação diferencial, para concentrar o máximo de número de plaquetas, que é então injetado de volta no paciente no local da lesão ou da patologia. Na centrifugação diferencial, a aceleração é ajustada para sedimentar certos constituintes celulares com base na diferença de massa específica (DHURAT; SUKESH, 2014).
O PRP autólogo, preparado com o sangue do próprio paciente, é preferido por diminuir a chance de efeitos adversos do tratamento. É um produto orgânico, atóxico e não imunorreativo, e tem sido utilizado para acelerar os caminhos da cicatrização da ferida cirúrgica. Tem aplicação em áreas multidisciplinares, mostrando resultados promissores especialmente na regeneração tecidual e na cicatrização, por ser considerado um agente catalisador no processo de reparo. Diversos estudos na literatura demonstram que os fatores de crescimento derivados das plaquetas são os principais responsáveis pela aceleração da regeneração tecidual e outros efeitos terapêuticos do PRP, sendo que se destaca, entre os fatores de crescimento presentes no PRP, o PDGF (Fator de crescimento derivado de plaquetas), considerado iniciador universal da maior parte do processo de cicatrização (COSTA; SANTOS, 2016).
Borzini e Mazzucco (2007) relatam em seu artigo de revisão da literatura que, entre centenas de trabalhos publicados sobre o uso clínico dos derivados de plaquetas, muito poucos pertencem à classe dos ensaios clínicos randomizados prospectivos ou à categoria dos ensaios clínicos retrospectivos. A grande maioria dos trabalhos publicados pertence à categoria de relatos de caso ou estudos piloto. Apesar desta falta de estudos da categoria de ensaios clínicos randomizados, os autores citam que, analisando cuidadosamente os trabalhos publicados, existem fortes evidências de que o gel de plaquetas (PRP) é clinicamente efetivo (BORZINI; MAZZUCCO, 2007).
Há uma série de protocolos descritos para obter o PRP, entretanto, em geral, inclui um processo de centrifugação por meio do qual os diferentes componentes do sangue total são separados de acordo com suas diferentes densidades. Os protocolos diferem em tempo, velocidade e número de centrifugações às quais o sangue total é submetido. O volume da amostra de sangue inicial e os tipos de tubos de coleta e anticoagulantes usados também são diferentes para cada método (DOHAN et al., 2009).
Até o momento, não há consenso sobre o melhor método de preparação do PRP. O volume de sangue adquirido, concentração de plaquetas, presença de leucócitos e eritrócitos, uso de kit de preparação versus manuseio manual, etapas de centrifugação, métodos de ativação, número e tempo de injeções, e cuidados no procedimento proporcionam grandes variações em formulações e resultados (SCHNEIDER; SILVA, 2020).
Embora não haja acordo sobre o que é a melhor concentração, a concentração de plaquetas no PRP é três a sete vezes maior do que no sangue periférico e é considerado suficiente para ter efeitos terapêuticos no rejuvenescimento da pele (KIM et al., 2011), no tratamento de distúrbios pigmentares (como melasma e hiperpigmentação periorbital) (ÇAYIRLI et al., 2014; CH; AMINI, 2015; AL-SHAMI, 2014) e na cicatrização de fer
5. USO DO PRP NO MELASMA
Recentemente, o PRP chamou a atenção em medicina estética como uma possível terapia alternativa ou adjuvante. Como uma fonte concentrada de plaquetas autólogas, PRP contém vários e diferentes fatores de crescimento e outras citocinas que podem estimular várias funções de tecidos moles, como cicatrização de feridas e produção de colágeno. Portanto, o PRP é promissor como um tratamento eficaz com menos efeitos colaterais e menos hiperpigmentação de rebote do que outros tratamentos de melasma (SIRITHANABADEEKUL; DANNARONGCHAI; SUWANCHINDA, 2009).
A eficácia terapêutica do PRP é baseada na premissa de que os grânulos α das plaquetas contêm abundância de fatores de crescimento, como fator de crescimento derivado de plaquetas, fator de crescimento transformador beta (TGF-β 1, 2), fator de crescimento semelhante à insulina (MARX, 2004), moléculas de adesão, integrinas e várias citocinas (AL-SHAMI, 2014). Esses fatores de crescimento se ligam a seus receptores cognatos expressos sobre o epitélio cutâneo e células-tronco mesenquimais, fibroblastos, células endoteliais e queratinócitos e, portanto, induz as vias de transdução de sinal com subsequente expressão de genes e a liberação de proteínas envolvidas na melanogênese e reparo tecidual (AL- SHAMI, 2014; MARX, 2004).
O conteúdo mais importante das plaquetas está contido nos grânulos alfa. Existem mais de 30 substâncias bioativas nesses grânulos-alfa, incluindo fator de crescimento derivado de plaquetas (PDGF), fator de crescimento transformador (TGF) β1 e β2, fator de crescimento epidérmico, fatores de crescimento mitogênicos, como fator de angiogênese derivado de plaquetas, e fibrinogênio (SMYTH et al., 2009).
Kim et al. investigaram os efeitos do TGF-beta 1 na melanogênese e afirmaram que essa inibe a síntese de melanina. No estudo investigaram os efeitos do TGF-β1 na melanogênese usando células de camundongos (melanócitos). Os resultados mostraram que o TGF-β1 inibe significativamente a síntese de melanina de uma maneira dependente da concentração e que reduz a atividade da tirosinase, a enzima melanogênica. Também descobriram que o TGF-β1 reduz a produção de tirosinase, proteína relacionada à tirosinase-1 (TRP-1) e proteína TRP-2 (KIM; PARK; PARK, 2004).
Em um estudo de caso em 2013, Cayirli e colaboradores aplicaram PRP numa paciente de 27 anos com melasma há 5 anos na região de bochechas, fronte e região perioral. A paciente foi orientada a usar protetor solar apenas e após 3 sessões de PRP por mesoterapia (a cada 15 dias) houve regressão do melasma em 80% e por 6 meses não houve recidiva.
Figura 14 – Foto de estudo. Fonte: Cayirli et al. (2013).
Em um estudo experimental randomizado Sirithanabadeekul P. et al. (SIRITHANABADEEKUL; DANNARONGCHAI; SUWANCHINDA, 2009), em 2019, realizaram um estudo com 10 pacientes do sexo feminino com melasma do tipo misto com idades de 18 a 65 anos, com fototipo III e IV. Foi aplicado PRP (condição PRP) num lado do rosto e no outro foi aplicado solução salina (condição CONTROLE), cada duas semanas, por injeções intradérmicas, totalizando 4 sessões. As pacientes usaram apenas protetor solar e não podiam usar outro tipo de tratamento. Descobriram que a injeção de PRP melhora significativamente o melasma dentro de 6 semanas de tratamento. Os níveis de melanina tiveram uma diminuição gradual na condição PRP a partir da sexta semana, a satisfação do paciente melhorou significativamente entre as semanas 2 e 10 na condição PRP e não mudou na condição controle. Não houve melhora na vermelhidão da pele em termos de índice de eritema.
Em outro estudo Gamea et al., em 2020, usou-se ácido tranexâmico associado ao PRP para tratamento do melasma. Dividiram 40 pacientes em dois grupos iguais (Grupo A e B), onde os dois grupos usaram creme tópico de ácido tranexâmico 5% duas vezes ao dia por 12 semanas, e somente o grupo B recebeu também PRP aplicado intradermicamente a cada 3 semanas por 12 semanas. Todos foram instruídos a usar protetor solar antes de se expor ao sol. O PRP adicionou um efeito muito benéfico ao ácido tranexâmico no tratamento do melasma, concluindo- se que, apesar do ácido tranexâmico sozinho ser um tratamento eficaz e seguro, se associado ao PRP aumenta o efeito terapêutico deste, então sua combinação produziu resultados melhores do que ácido tranexâmico sozinho.
Hofny et al., em 2019 realizaram uma investigação para testar a hipótese de que a injeção de PRP na pele lesionada de pacientes com melasma é associada a alterações na expressão da proteína TGF- β. Vinte pacientes do sexo feminino com melasma e nove voluntários saudáveis (sem melasma) participaram do estudo. Biópsia das lesões de pele com melasma foram obtidas antes e após aplicação do PRP. Também foi realizado biópsia da pele perilesional e da pele facial dos voluntários saudáveis. Houve melhora na hiperpigmentação das células basais na pele de pacientes com melasma após tratamento com PRP; havia diminuição da expressão da proteína TGF- β nas lesões de melasma (antes do tratamento com PRP) comparado com pele saudável e perilesional, mas na pele perilesional também estava diminuída; houve um aumento da expressão da proteína TGF- β na pele com melasma após tratamento com PRP.
Figura 15 – Foto de estudo [2]. Fonte: Hofny et al. (2019).
O aumento da expressão da proteína TGF- β após tratamento com PRP é fundamentado no enriquecimento da pele por fatores de crescimento incluindo TGF- β, liberado após desgranulação de grânulos α das plaquetas concentradas no PRP (HOFNY et al., 2019). TGF-β é bem conhecido por seus efeitos estimuladores autócrinos e, portanto, é concebível propor que a proteína TGF-β (um dos conteúdos de PRP) aumenta a transcrição do gene TGF-β em mRNA de TGF-β com subsequente aumento da síntese e inibição da proteína TGF-β dos melanócitos, resultando na diminuição da produção de melanina (melanogênese) e melhora clínica do melasma (melhora da hiperpigmentação epidérmica) (DERYNCK; MIYAZONO, 2008).
Em um estudo de caso Garg et al., em 2018 (GARG; KHILLAN; BHARIJA, 2018) , relatam o caso de uma mulher de 42 anos que tinha melasma há quatro anos e por um período de dois anos fez uso regular de protetor solar e tratamento tópico contendo esteroides, tretinoína, hidroquinona , ácido kójico, arbutina, etc. sem sucesso no tratamento , iniciou tratamento via oral com ácido tranexâmico e uso tópico de despigmentantes com mometasona, tretinoína e hidroquinona além de fazer 6 sessões de peelings químicos com ácido glicólico e tretinoína. Apesar dessa segunda tentativa de tratamento quase não houve melhora do seu melasma. Decidiu-se, então, adicionar terapia com PRP intradérmico. Foi descontinuado o tratamento via oral e aplicação tópica foi alterada para uma combinação de ácido kójico e arbutina, além do uso de protetor solar e das aplicações intradérmicas de PRP. Foram feitas seis aplicações de PRP, com intervalos variados, num período de oito meses, nas áreas de melasma. A paciente foi vista e fotografada após seis semanas da sua última aplicação (ver fotos abaixo) e a paciente decidiu por descontinuar o tratamento com PRP pois já estava muito satisfeita com o resultado. Após 3 meses a paciente continuava sem recidiva, porém seguia utilizando o tratamento tópico com arbutina e ácido kójico.
Figura 16 – Foto de estudo [3]. Fonte: Garg; Khillan; Bharija (2018).
Em um estudo de casos, Hofny et al., em 2018, realizaram um estudo em que, além de avaliar o resultado da aplicação de PRP em áreas de melasma, também compararam de que modo era feita a entrega do plasma na pele. Participaram da pesquisa 23 pacientes com fototipos III e IV e receberam PRP de um lado da face através de microagulhamento com dermapen e outro lado da face com injeções intradérmicas. As aplicações foram realizadas cada 4 semanas por um período de 3 meses, e após 1 mês da última aplicação foram feitas fotos (Figura 17). Os resultados do trabalho indicaram claramente que a aplicação do PRP está associada a um significativo e excelente melhora em pacientes com melasma, e a diferença entre os lados foi insignificante com exceção de um parâmetro em que indicava vantagem do microagulhamento, além de ter causado menos dor que as injeções intradérmicas.
Figura 17 – Foto de estudo [4]. Fotos Hofny et al. (2018).
6. CONSIDERAÇÕES FINAIS
O melasma é uma hiperpigmentação da pele e suas causas são variadas e os tratamentos também. Não causam problemas sistêmicos, mas podem levar a problemas psicológicos pela sua aparência inestética. O melasma é uma discromia de difícil tratamento em que o mais indicado ainda é um conjunto de terapêuticas que atuem sobre os diferentes fatores etiológicos. O plasma rico em plaquetas é um concentrado de proteína plasmática rico em fatores de crescimento que vem sendo muito usado em diversos ramos da área da saúde.
Alguns estudos vêm surgindo quanto ao seu uso na terapia do melasma. Vários autores relatam melhora significativa na aparência do melasma com o uso do PRP, outros ainda associam a técnica com outros tratamentos, potencializando os seus resultados. Na maioria dos relatos de caso, foram realizadas duas centrifugações para obtenção do PRP. Apesar de alguns poucos estudos demonstrarem onde e como o PRP atua na melanogênese, ainda são necessários mais estudos randomizados para podermos entender como e onde age realmente o PRP na cascata da produção desregulada da melanina.
Pode-se afirmar, no entanto, que em vários estudos e relatos de casos o melasma apresentou significativa melhora com o uso do PRP.
Tenha acesso à nossa newsletter semanal e participe do Instituto Velasco PLAY, com video-aulas, artigos, ebooks, tudo 100% GRATUITO para profissionais da Harmonização Facial!


